细胞死亡,包括细胞凋亡
9.1 简介
坏死细胞通常由质膜缺乏完整性来定义,这可以通过流式细胞仪进行测量。相反,凋亡细胞具有完整的质膜。 在体内,除了可能在大肿瘤的坏死中心外,坏死和凋亡细胞将通过吞噬作用从体内清除。 体外,凋亡细胞最终会失去膜的完整性,有时称为继发性坏死。坏死和细胞凋亡之间最明显的区别是细胞凋亡是一个有序的过程,旨在去除不需要的细胞。它也可以由细胞损坏触发。坏死是一个无序的过程。这种差异在核形态的变化和 DNA 的降解方面很明显。这两种改变在细胞凋亡中是结构化的,而在坏死期间是非结构化的。
9.2 细胞活力
质膜完整性的丧失可以通过使用染料来证明,例如碘化丙啶 (PI),它们被完整的膜所排除,或者使用仅在膜完整时才保留在细胞中的荧光染料。在后一类中,通常使用荧光素二乙酸酯 (FDA) 或羧基荧光素二乙酸酯。FDA 不带电并扩散到细胞中。在细胞中,它被转化为荧光素,带电的荧光素保留在活细胞中。图 9.1显示了一个示例 。活细胞是荧光素+ve、PI -ve 和死细胞荧光素-ve、PI +ve。
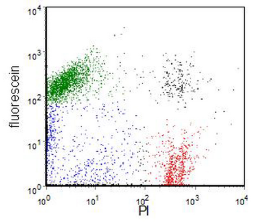
图 9.1。 用 FDA 和 PI 标记的人卵巢癌细胞系。绿色:活细胞。红色:死细胞。一些蓝色细胞可能是凋亡的。双染色细胞(黑色)是团块。 数据文件
9.3 细胞凋亡
9.3.1 简介
在开始使用流式细胞仪进行任何细胞凋亡研究之前,您应该尽可能首先通过目测确定这些细胞的存在,而不应依赖于各种流式细胞仪检测。凋亡细胞最初是通过其细胞核的特征性变化来识别的。这仍然是确认他们身份的最佳方法。通过用 DNA 染料染色和使用荧光显微镜可以观察到细胞核的变化(图 9.2)。
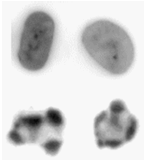
图 9.2。 正常(顶行)和凋亡 HL60(人早幼粒细胞系)细胞,用 PI 染色并通过共聚焦显微镜观察。
使用流式细胞术可以观察到凋亡级联的以下特征。
参与细胞凋亡的蛋白质的表达
半胱天冬酶的激活
线粒体膜电位的变化
质膜的变化
细胞收缩
染色质变化
DNA降解
所涉及的方法将在以下部分中更详细地描述。Ormerod (2001) 发表了关于流式细胞术和细胞凋亡的文献综述。Ormerod (2000) 也描述了一些实验方法。
9.3.2 蛋白质表达
只要有合适的抗体并且存在足够的蛋白质拷贝,任何参与凋亡过程的蛋白质都可以通过流式细胞术进行测量。特别重要的是一个称为半胱天冬酶(半胱氨酸天冬氨酸特异性蛋白酶)的酶家族,它驱动凋亡级联,Bcl-2 蛋白家族控制级联和线粒体蛋白,它们在促进和促进细胞凋亡中起核心作用。级联控制。
现在有许多仅在凋亡细胞中发现的蛋白质可用的抗体,例如切割的多聚(ADP-核糖)聚合酶(PARP)和活化的半胱天冬酶。合适的方法在 第 5 章中讨论。
9.3.3 半胱天冬酶的激活
在正常细胞中发现半胱天冬酶作为无活性的酶原(procaspases)。活性半胱天冬酶可以激活其他半胱天冬酶,建立“半胱天冬酶级联”。一般来说,它们可以分为引发剂(例如,caspase 8)和执行者(例如,caspase 3)caspase。
可以使用抗体在固定细胞中观察到活化的半胱天冬酶。使用未固定的活细胞的测定基于共价连接到特定于感兴趣的活性半胱天冬酶的短肽序列的荧光化合物。
当罗丹明 110(一种在 488 nm 激发的绿色荧光染料)与肽连接时,其荧光被淬灭。当肽被适当的半胱天冬酶切割时,荧光罗丹明110被释放。这种测定的问题是罗丹明肽化合物扩散到活细胞中的速度很慢。另一种以类似原理工作的测定法使用商品名为 PhiPhiLux (OncoImmunin Inc.) (Komoriya et al. , 2000) 的试剂。使用肽接头使基于罗丹明的荧光化合物二聚化。两个分子的紧密接近会淬灭它们的荧光。在细胞中,如果肽被切割,就会释放出两个荧光单体。示例 如图 9.3所示. 使用的探针与 caspase-3 特异性肽序列 DEVDGI 相连。加入了 TO-PRO-3,一种与 DNA 结合但被活细胞排除的二花青素染料。在正常细胞的制备中存在一些死细胞(通过 TO-PRO-3 阳性染色显示)。在用细胞毒性药物星形孢菌素处理后,有一群具有完整细胞膜的凋亡细胞,并且吸收 DNA 染料的细胞百分比大幅增加。这些细胞对 PhiPhiLux 呈阴性,它已从膜受损的细胞中扩散出来。
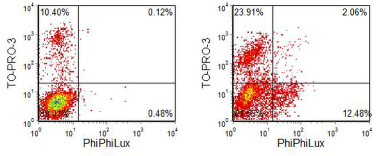
图 9.3。 MDCK,狗肾细胞系。 一个。未经处理的对照。 乙。与星形孢菌素一起孵育。细胞被加载对 caspase 3 特异的 PhiPhiLux,并添加了 TO-PRO-3。双激光,488 和 630 nm。数据由 CRC-UK 伦敦实验室信号转导实验室的 Derek Davies、Sandra Watton 和 Julian Downward 提供。 数据文件
在所谓的 FLICA(荧光染料标记的半胱天冬酶抑制剂)测定中使用了一种不同的方法(Bedner 等人,2000)。氟甲基酮 (FMK) 连接到肽序列的一端,而羧基荧光素连接到另一端。当肽与 caspase 的活性位点结合时,FMK 可能会发生反应,阻止进一步的活性,因此荧光产物将在具有活性 caspase 的细胞中积累。
9.3.4 线粒体膜电位的变化
线粒体在细胞凋亡中起核心作用,在此期间膜电位崩溃,这种变化最好通过流式细胞术测量(Zamzami 等,1995)。有几种染料被隔离在线粒体中(Galluzi 等人,2007)。它们包括氯甲基-X 罗糖胺、罗丹明 123 和 3,3'-二己基氧杂羰花青 - DiOC 6(3)。当线粒体膜电位 (MMP) 崩溃时,染料会在细胞质中重新分布并与外部介质形成新的平衡,从而导致染料从细胞中流失。另一种二花青染料是JC-1,其荧光会根据染料的聚集状态从绿色变为红色,因此当染料集中在线粒体中时,会发出红色荧光;在释放时,它会被稀释并发出绿色荧光。测量绿色与红色荧光的比率。染料四甲基罗丹明乙酯高氯酸盐 (TRME) 以类似的方式工作。当染料被隔离在线粒体中时,荧光被淬灭;在其释放到细胞质中时,其荧光增加。
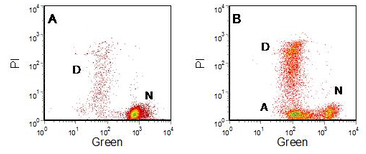
图 9.4。用 DiOC 6 (3) 标记的人淋巴母细胞系 W1L2 。PI 补充说。 一个。控制。 乙。与 KCN 一起孵育 16 小时。标签表示正常 (N)、凋亡 (A) 和“坏死” (D) 细胞。 数据文件
图 9.4 显示了使用染料 DiOC 6 (3) 观察细胞凋亡过程中 MMP 的减少。添加 PI 以区分质膜受损(“继发性坏死”)的细胞。在未处理的对照培养物中,大多数细胞为绿色阳性和红色(PI)阴性;一些细胞死亡(PI 阳性)。与KCN一起培养的细胞中,出现了一个新的群体,绿色弱,PI阴性;这些是凋亡细胞。
MMP 的减少使呼吸链解耦,导致超氧阴离子和其他活性氧中间体增加,这可以使用二氢乙啶 (Zamzami 等人,1995a) 或 2', 7'-二氯二氢荧光素 (Verhaegen 等人,1995 ) 检测)(见 第 9.6 节)。与 MMP 损失相关的其他变化是还原型谷胱甘肽浓度的降低、细胞内 Ca++ 浓度的增加和细胞内 pH 值的降低。第 10 章描述了测量这些参数的方法 。
9.3.5 质膜的变化
膜联蛋白 V 结合
在细胞凋亡过程中,通常位于质膜内表面的磷脂酰丝氨酸 (PS) 残基重新分布到外表面。PS 与蛋白 Annexin V 结合,通过将未固定的细胞与标记的 Annexin V 一起孵育可以观察到这种变化(van Engeland 等人,1998)(图 9.5)。请注意,死亡和凋亡细胞的前向散射减少,侧向散射增加。膜联蛋白 V 染色剂可以很容易地与表面抗原染色剂结合使用。
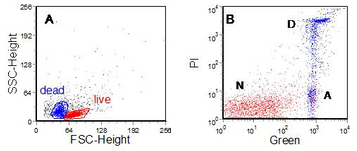
图 9.5。 用苯丁酸氮芥培养的人类慢性淋巴细胞白血病细胞,然后是膜联蛋白 V-FITC。PI 补充说。 一个。光散射。 乙。PI 与 Annexin V。标签表示正常 (N)、凋亡 (A) 和“坏死” (D) 细胞。数据由威尔士珀纳斯兰多医院血液科 Chris Pepper 提供。 数据文件
增加膜通透性
凋亡细胞对各种 DNA 结合染料的渗透性更强,例如溴化乙锭、7-AAD (Schmid et al. , 1994)、YO-PRO-1 (Idziorek et al. , 1995) 和 Hoechst 33342 (Ormerod et al., 1995)等人,1993 年)。图 9.6中的数据 显示了凋亡细胞如何首先摄取 YO-PRO-1,然后随着质膜的退化,它们摄取越来越多的 PI。PI 淬灭 YO-PRO-1 荧光,因此绿色荧光减少。最后,随着 DNA 的降解,PI 荧光也会降低。箭头标记了这个“死亡循环”的运动方向。
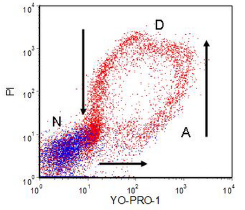
图 9.6。 与苯丁酸氮芥一起培养的人 AML 细胞。与 YO-PRO-1 一起孵化;PI 补充说。蓝色的细胞从它们的光散射中被识别为正常;(N),那些红色的是死的 (D) 和凋亡的 (A) 细胞。进一步讨论见正文。细胞由 Louise Truran 制备,当时在威尔士大学医院血液科。 数据文件
第二个例子(图 9.7)显示了凋亡细胞对 7-AAD 的部分摄取;当质膜破裂时,7-AAD 荧光增加一百倍。请注意,细胞凋亡期间前向散射减少。这些未成熟的胸腺细胞也被标记为 CD4-PE 和 CD8-FITC。未成熟的胸腺细胞共同表达两种抗原,活细胞和凋亡细胞上的颜色门控表明这些表面蛋白在细胞凋亡过程中被下调。
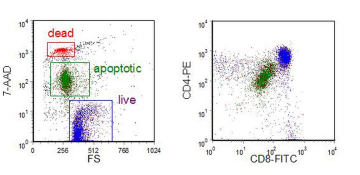
图 9.7。 未成熟的人类胸腺细胞与地塞米松一起培养。然后将细胞与抗 CD4-PE 和抗 CD8-FITC 孵育,然后与 7-AAD 孵育。数据由加州大学洛杉矶分校医学院 Ingrid Schmid 提供。 数据文件
9.3.6 DNA 降解
DNA直方图
在凋亡级联的晚期阶段,核酸内切酶破坏了核小体之间的接头,这是染色质组织的单位之一。因此,大量的 DNA 小片段,其大小约为 180 bp 的寡聚体,在细胞中积累。如果将细胞固定在乙醇中并随后再水化,则一些较低分子量的 DNA 会渗出,从而降低 DNA 含量。这些细胞可以在 DNA 直方图中观察为亚二倍体或“亚 G1”峰(图 9.8)。峰可能被碎片污染,这些碎片通常可以通过使用光散射从分析中消除。提取的 DNA 量 - 以及亚 G1 峰的位置 - 取决于所研究的细胞类型和重悬细胞的缓冲液 (Gong et al. , 1994)。
如果用这种方法计算凋亡细胞的百分比,应该有一个明显的亚G1峰,如图所示。像通常所做的那样,在 G1 以下设置一个区域并断言其中的粒子数是凋亡细胞的计数是不正确的。虽然降解的材料是这个区域可能来自凋亡细胞,但一个凋亡细胞可能已经产生了几个片段。
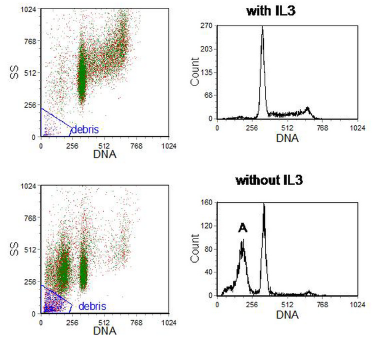
图 9.8。 鼠造血细胞系 BAF3 在有或没有生长因子 IL-3 的情况下生长 16 小时。将细胞固定在 70% 乙醇中并用 PI 重新悬浮在 PBS 中。DNA 直方图已被选通以仅包括单个细胞(未显示 DNA 峰与面积的图)并排除碎片。'A' 标志着亚 G1 峰(凋亡细胞)。 数据文件
TUNEL 检测
末端脱氧核苷酸转移酶 (Tdt) 酶将核苷酸添加到凋亡细胞中 DNA 片段的 5' 末端。使用标记的核苷酸(例如,BrdUTP),随后可以将其可视化(在这种情况下,使用抗 BrdUrd-FITC)。在乙醇中固定之前,将细胞固定在甲醛(通常为 1% 多聚甲醛)中,以便将 DNA 片段交联到细胞中并最大限度地增加断裂 DNA 末端的数量。由于片段化的 DNA 被保留,凋亡细胞的 DNA 含量将反映从细胞凋亡开始的细胞周期阶段。
图 9.9 至 9.12显示了四个示例 。首先,标记的核苷酸是生物素-11-dUTP,用链霉亲和素-FITC 可视化。细胞从细胞周期的 G1 开始发生凋亡。在其他示例中,使用 BrdUTP,然后使用抗 BrdUrd-FITC。在 图 9.10中,发生凋亡的细胞来自 S 期。
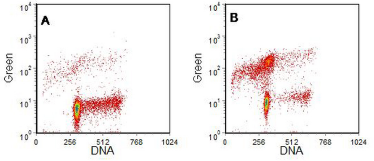
图 9.9。 图 9.8中描述的单元格 。 A与 IL-3一起孵育, B与 IL-3 一起孵育。使用 TUNEL 检测进行标记。由伦敦皇家马斯登医院生物化学学术系 Simone Detre 制备的细胞。 数据文件
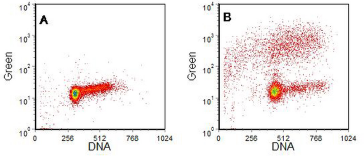
图 9.10。 HL60(人早幼粒细胞系)细胞。 A、对照细胞; B,与喜树碱一起孵育 4 小时。TUNEL 检测。Phoenix Flow Systems 提供的电池。 数据文件
最后两个示例(图 9.11 和 12)显示来自乳腺癌细针穿刺 (FNA) 的数据。将细胞分选到显微镜载玻片上并捕获荧光图像。来自标记细胞的细胞核图像不像来自细胞培养物的那样清晰,但形态与预期的凋亡细胞并不不一致。在 图 9.12中,一些分选的细胞具有正常的细胞核,细胞质中有明亮染色的凋亡小体。这些似乎是吞噬了相邻凋亡细胞的肿瘤细胞(Dowsett 等,1998)。
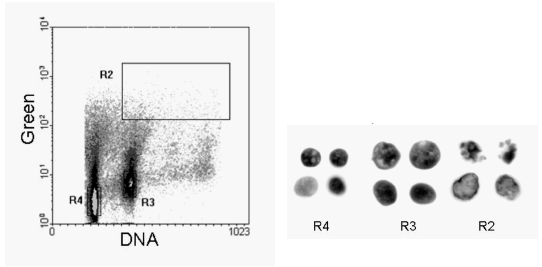
图 9.11。 用 TUNEL 检测标记的乳腺癌细针吸出物。细胞被分选到显微镜载玻片上,并通过荧光显微镜捕获图像。R4 区域是二倍体核;R3,非整倍体和 R2,标记的非整倍体细胞核。
上一篇:流式细胞术的一些临床应用
下一篇:DNA 分析

 售前咨询专员
售前咨询专员
